引言
作为源自阿尔托大学顶尖科研成果的产学研初创企业,自 2013 年起,Maculaser 植根于芬兰阿尔托大学顶尖生物医学工程实验室的前沿研究,聚焦年龄相关性黄斑变性(AMD)、糖尿病黄斑水肿(DME)及中心性浆液性脉络膜视网膜病变(CSC)等视网膜疾病的创新治疗,凭借其基于激光热疗的核心技术,开辟了一条 “无损伤、个性化” 的治疗新路径,正从实验室快速迈向临床应用。公司通过温和局部加热实现的视网膜修复疗法,旨在激活靶细胞内的天然防御机制,同时避免产生全身效应。其创新性的视网膜温度控制技术,不仅能实现激光诱导加热的个性化调节,还可针对致盲性眼病开展早期治疗 —— 相比晚期阶段的药物注射治疗,该技术能更早介入干预。
01 科学机制
视网膜色素上皮细胞(RPE)是维持视觉功能的核心细胞,随年龄增长或氧化应激影响,RPE 细胞内蛋白质易出现错误折叠并聚集,形成干性 AMD 的标志性病变 —— 玻璃膜疣。这些错误折叠的蛋白质是干性年龄相关性黄斑变性的标志,人体可以通过三种方式进行处理:热休克蛋白:这些蛋白是在热应激反应中产生的,其作用是将受损的蛋白质重新折叠成正确的形状;蛋白水解:如果蛋白质折叠失败,错误折叠的蛋白质将被分解成氨基酸;自噬:当蛋白质已经积累形成时,身体会采用一种称为自噬的废物处理过程。
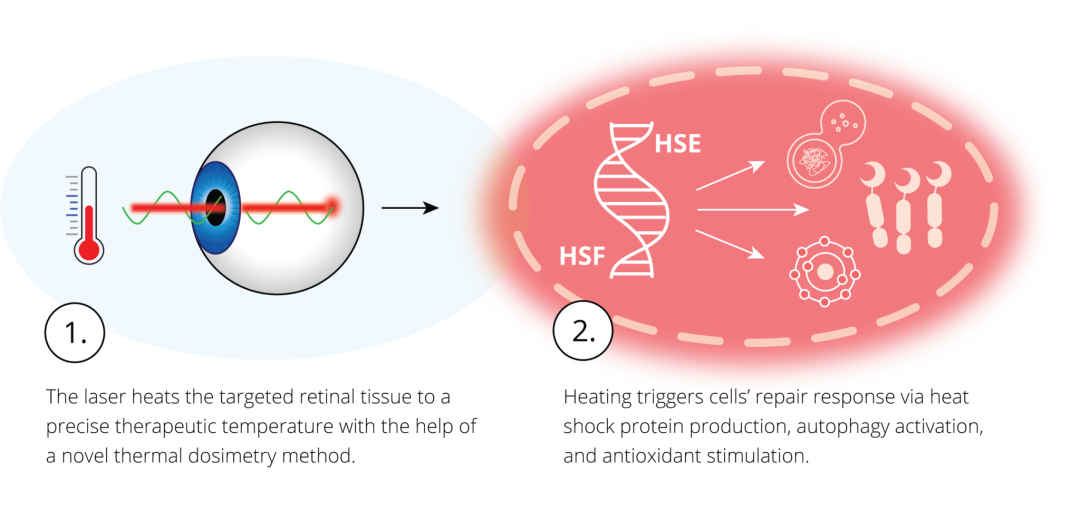
Maculaser 技术的核心科学逻辑,是通过精准热暴露激活视网膜细胞的天然愈合机制,从根源对抗退行性病变:将目标视网膜细胞加热到特定的治疗温度范围,会激活局部热休克反应。这种天然的修复反应会触发一系列过程,例如热休克蛋白的产生、自噬的激活以及抗氧化机制的刺激——所有这些过程都旨在修复或清除受损的细胞成分,从而促进视网膜的恢复和再生。
1.1 热休克蛋白:修复受损蛋白的 “分子伴侣”
Maculaser 的激光热疗将视网膜温度精准控制在 44℃左右,可诱导 RPE 细胞产生热休克蛋白(如 HSP70、HSP90)。这类蛋白作为分子伴侣,能识别并纠正错误折叠的蛋白质结构,阻止其进一步聚集,这种关键反应能够保护健康蛋白免受氧化损伤,恢复细胞正常功能。
1.2 自噬激活:清除细胞废物的 “垃圾清理系统”
当错误折叠蛋白已形成聚集物时,热疗会进一步激活细胞的自噬机制。自噬是指将受损蛋白质包裹在脂质膜内,并由识别蛋白标记。这些识别蛋白引导溶酶体酶降解和回收细胞废物,这一过程由诺贝尔奖得主大隅良典于2016年发现。
自噬的激活对视网膜健康至关重要,它参与清除和回收细胞废物,从而使视网膜恢复活力。自噬靶向衰老、受损的细胞成分,增强视网膜的修复过程,并维持其最佳功能。通过这种天然的清洁过程,自噬在维持视网膜的结构和功能完整性方面发挥着关键作用,有助于增强视网膜抵抗退行性疾病的能力。
1.3 抗氧化系统:抵御氧化应激的 “防护屏障”
氧化应激是视网膜损伤的主要诱因之一,长期光照、高代谢率使 RPE 细胞持续暴露于氧自由基威胁中。热疗可刺激视网膜细胞增强抗氧化酶(如超氧化物歧化酶 SOD1、谷胱甘肽过氧化物酶 GPX1)的表达,强化细胞自身的 “抗氧化屏障”,减少氧自由基对蛋白质、脂质的损伤,从源头降低视网膜退行性病变的风险。
02 技术优势
无损伤视网膜热疗的核心目标,是利用温度升高所带来的再生效应,在不损伤脆弱视网膜组织的前提下促进愈合。Maculaser 的激光热疗技术之所以被视为视网膜治疗领域的突破,源于其针对传统疗法 “精度低、风险高、个体适配性差” 等痛点的创新设计,采用视网膜温度监测技术,充分考量患者个体差异及视网膜不同区域的生理差异,确保每位患者都能获得安全、有效且稳定的治疗效果。核心优势集中在三方面:
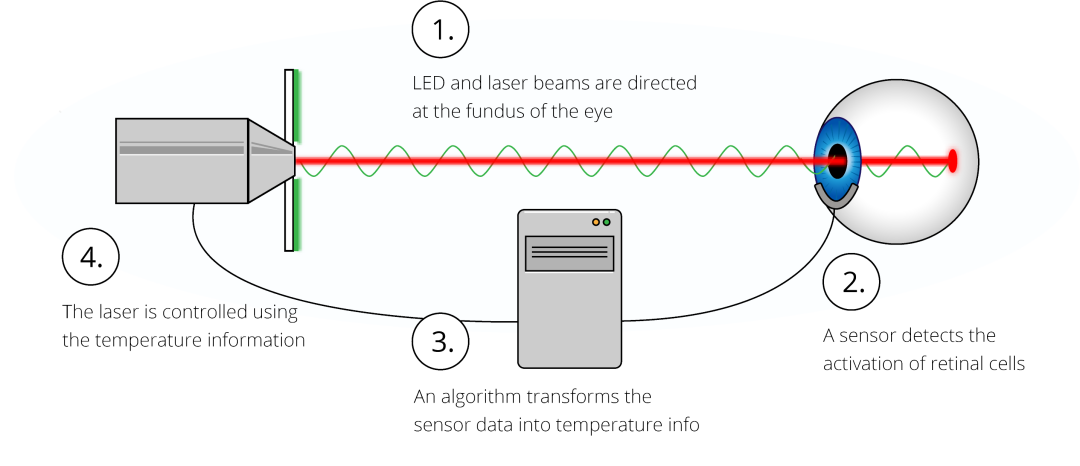
2.1 精准温控
视网膜组织脆弱敏感,诱导治疗性热休克蛋白产生的温度范围很窄,且激光诱导的温度升高高度依赖于个体特征。Maculaser 创新性地将局灶性视网膜电图(fERG)技术与激光治疗结合,通过实时监测视网膜对光的生物电反应,动态调整激光功率,实现对视网膜温度的精准调控 —— 在损伤阈值附近的温度测定精度可达 0.6℃,确保治疗始终处于 “安全有效” 的黄金区间,避免过热损伤或疗效不足。
2.2 非接触设计
Maculaser 采用现代化的用户界面设计不仅使治疗过程更加人性化,也方便了医生操作。治疗光束通过固定式非接触透镜照射到眼底,无需人工操作。
2.3 多重安全保障
为进一步提升安全性,技术内置双重安全机制:一是主动温度监测,若实时检测到视网膜温度接近 48℃的损伤阈值,系统会自动中断治疗;二是自动瞳孔追踪,若患者治疗中出现眼球过度移动,导致激光光斑偏离目标区域,设备会立即停止照射,确保治疗全程 “精准且可控”,避免意外损伤。
03 相关研究成果
Maculaser 的核心技术已获得多项临床前研究,以验证治疗机制与技术可行性,相关成果发表于《自然・通讯》等国际顶级期刊,为临床转化提供坚实的科学依据。
接下来,按时间先后顺序梳理该技术的研究成果脉络。

3.1 早期探索:小鼠离体视网膜温度监测研究(2017 年)
2017 年发表于《Annals of Biomedical Engineering》的该研究,提出一种基于视网膜电图(ERG)的小鼠视网膜温度测定创新方法,首次阐明其监测原理并验证可行性,为后续视网膜热疗精准温控奠定基础。研究核心依据 ERG 光响应的温度依赖性特征:视网膜温度会影响 ERG 光响应的动力学(反应速度)和振幅(信号强度),且温度升高会增加长波长光子吸收概率,表现为光感受器敏感性的温度依赖性。研究从小鼠离体视网膜的 ERG 闪光响应中,提取 a 波、b 波相关特征,构建了 3 个温度与特征关联的多变量回归模型。经独立测试数据集验证,其中 2 个模型的温度测定均方根(RMS)误差小于 0.50℃,证实该方法可实现离体视网膜的可靠温度测定。此外,该方法能反映视网膜远端温度,还可延伸用于估算视网膜色素上皮细胞(RPE)温度,为后续体内实验及临床热疗温度监测提供了关键方法学支撑。
3.2 技术可行性:小鼠视网膜温度体内实时监测(2019 年)
2019 年发表于《Experimental Eye Research》的该研究,针对无损伤视网膜热疗中温度精准控制缺失的痛点,提出一种基于视网膜电图(ERG)的小鼠视网膜温度体内实时监测新方法,为热疗精准化提供关键技术支撑。研究利用 ERG 光反应的温度依赖性,以 a 波、b 波动力学为温度信息来源,量化其与温度的关联并建立两个线性回归模型:基于单次光反应 a 波的模型,温度估计均方根误差小于 0.9°C;基于五次弱光刺激 b 波的模型,误差进一步降至 0.7°C 以下。此外,研究还测试了方法对光刺激强度变化的敏感性,确定了适用于连续温度监测的刺激间隔。该方法实现了小鼠活体视网膜及 RPE 温度的无创、精准监测,且人类 ERG 同样具有温度依赖性,为该技术向临床热疗转化提供了重要依据,助力解决视网膜疾病热疗的安全可控难题
3.3 作用机制研究:激光热疗诱导小鼠 RPE 细胞保护性反应(2020 年)
2020 年发表于《International Journal of Molecular Sciences》的该研究,探索了激光诱导热疗治疗视网膜疾病的新路径,核心是通过经瞳孔热刺激诱导小鼠视网膜色素上皮(RPE)细胞产生保护性反应。研究采用 1064nm 长时程激光加热 C57Bl/6J 小鼠眼底,聚焦热休克蛋白 70(HSP70)的表达与损伤风险的平衡。结果显示,有效诱导热休克反应的激光功率窗口极窄:64mW 功率下,HSP70 显著升高概率达 90%,损伤概率仅 20%;70mW 时 HSP70 表达激活率 100%,但损伤概率升至 33%。TUNEL 染色证实,激光功率 72mW 左右为 50% 损伤阈值(ED50),最高功率下 RPE 细胞出现萎缩。该研究证实,长时激光眼底加热可通过激活 HSP70 触发 RPE 细胞自身防御机制,为视网膜神经退行性疾病提供了基于热休克的治疗新思路,同时明确了安全有效的功率范围,为后续技术优化奠定基础。
3.4 技术拓展:ERG 用作视网膜温度监测仪(2020 年)
2020 年 6 月玛雅・皮特卡宁在阿尔托大学完成的博士论文,率先开创视网膜电图(ERG)在视网膜温度监测中的应用,为视网膜疾病热疗提供了精准温控新工具,显著提升治疗安全性与有效性。论文结合离体与角膜 ERG 两种互补技术,核心探索 ERG 用于视网膜温度估计的可行性:在离体实验中,量化了接近哺乳动物体温时热变化对 ERG 反应的影响,且证实离体视网膜视杆细胞功能保留良好,仅敏感性与光反应动力学略有变化,为研究提供可靠基础;通过角膜 ERG 评估温度诱导的参数变化,建立温度估计模型,在约 20 秒记录间隔内,均方根误差小于 0.7°C,验证了技术精准性。此外,研究还借助两种 ERG 技术,成功表征了新型 P4H-TM 酶缺乏小鼠模型的视网膜功能,明确其视锥细胞通路缺陷源于细胞本身,而非麻醉影响。该研究首次将 ERG 技术拓展为视网膜温度监测仪,填补了眼底加热治疗中温度精准监测的空白,为后续相关临床应用奠定关键基础。
3.5 临床应用基础奠定:基于 ERG 的视网膜温度监测技术与 SLT(2021 年)
2021 年,发表于《IEEE Transactions on Biomedical and Health Informatics》的该研究,针对亚阈值视网膜激光治疗(SLT)中温度升高个体差异大的痛点,提出一种基于聚焦式视网膜电图(ERG)的视网膜温度监测与控制新方法,为临床安全有效的热疗提供技术支撑。SLT 通过短暂升高视网膜色素上皮(RPE)温度触发治疗性热休克,但患者 RPE 色素沉着、脉络膜灌注差异导致温度升高因人而异,需精准监测。研究在离体猪视网膜和在体麻醉猪模型中展开,通过改变体温并记录不同温度下的明视 ERG 信号,发现其反应动力学随温度升高加快 —— 体内增幅为 3.6%-4.7%/°C(依赖刺激强度),离体 33-44°C 范围内稳定为 5.0%/°C。基于此建立的温度估计模型,经模拟验证,在激光照射超 30 秒、光斑直径超 3 毫米的场景下,可精准确定 SLT 稳态温度升高。该研究证实了 ERG 技术监测视网膜温度的可行性,为 SLT 治疗提供了个性化温控方案,能提升视网膜疾病热疗的重复性、安全性与有效性,为后续临床转化奠定关键基础。
3.6 作用机制深入研究:热休克疗法治疗年龄相关性黄斑变性(2023 年)
2023 年,阿尔托大学 Mooud Amirkavei 的博士论文《揭示热休克疗法治疗年龄相关性黄斑变性的作用机制》,聚焦年龄相关性黄斑变性(AMD)的非侵入性治疗。AMD 的核心病理与细胞抗氧化应激能力下降、稳态失衡相关,而热休克反应(HSR)与自噬是细胞关键防御通路。研究通过三部分实验验证核心假设:在人 ARPE-19 细胞中,兴奋性热休克(HHS)可激活 HSF1,上调自噬相关基因表达,促进 p62/SQSTM1 和 LC3B-II 水平瞬时升高,强化蛋白质稳态;在小鼠模型中,经瞳孔 1064nm 激光加热显示,64-70mW 功率可在 90%-100% 概率增强 HSP70 表达,且损伤风险控制在 20%-33%,证实热疗有效窗口狭窄;在猪模型中,810nm 激光 60 秒亚阈值治疗(SLT)结合 ERG 热剂量监测,44.2℃时可激活 HSP 表达与自噬,无氧化应激或凋亡,48℃为损伤阈值,温度测定误差 < 10%。该研究明确了热刺激调控细胞保护通路的精准条件,验证了 ERG 温控技术的必要性,为 AMD 等视网膜退行性疾病提供了非侵入性治疗新路径。
3.7 关键突破:无损伤激光治疗激活猪RPE的兴奋性热应激反应(2025 年)
2025 年10月,由阿尔托大学、卡罗林斯卡研究所等机构联合完成的研究(论文标题:《基于视网膜电图热剂量学的无损伤激光治疗可激活猪视网膜色素上皮细胞的兴奋性热应激反应》)发表在《Nature Communications》,在猪模型中证实:60秒810 nm 激光照射使温度升高至44°C可触发RPE/脉络膜中热休克蛋白的产生和自噬的激活,同时避免氧化应激、细胞凋亡和结构损伤。重要的是结果表明,在高于48°C的温度下会出现可见的病变,并且温度测定的精度为0.6°C。这些结果突出表明,通过 fERG 实时监测,可将视网膜温度精准控制在 44℃,能够可靠、安全地激活 RPE 中的细胞保护机制,提供了一种有前景的新治疗方法。

一系列研究不仅验证了 Maculaser 技术的科学性与可行性,更确立了其在 “无损伤视网膜激光治疗” 领域的技术领先性。
04 临床管线
Maculaser计划开展多项临床研究,除核心目标干性 AMD 外,Maculaser 还计划将技术拓展至湿性 AMD、黄斑水肿等常见视网膜疾病 —— 这些疾病均存在 RPE 细胞功能异常或氧化应激损伤的病理特征,有望通过激活细胞天然防御机制实现治疗效果。目前相关临床研究方案已在筹备中,未来将形成 “一技术多适应症” 的产品矩阵。下图展示了不同眼底疾病适应症在患病率、临床前研究进展、临床试验重点(可行性、安全性、有效性)以及治疗频次目标方面的管线布局:
中度干性 AMD+早期GA:预计 每年 4 次治疗
湿性 AMD:预计 每年 4 次治疗 + 抗 VEGF 联合方案
其他两类眼底退行性疾病:预计 单次治疗
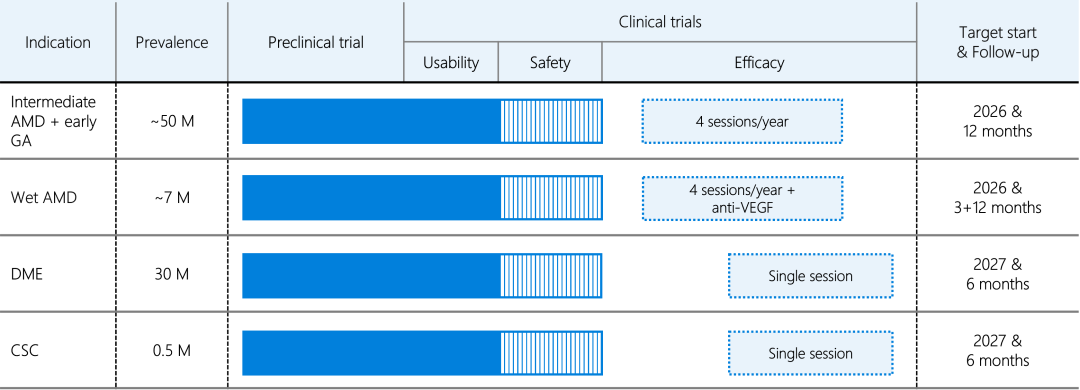
公司计划于 2026 年春季在芬兰启动首阶段人体临床试验,重点评估技术在干性 AMD 患者中的安全性;后续将逐步开展疗效验证,并探索最佳治疗间隔(研究显示单次治疗疗效可能在数日后减弱,需确定重复治疗周期)。按公司规划,该技术最快有望在 3 年内进入医院眼科临床应用,最终目标是成为社区眼科诊所可常规开展的治疗项目,让全球视网膜疾病患者实现 “早期干预、便捷治疗”。
青白视角评语
总体而言,Maculaser 的临床转化仍在早期阶段,但其“无损伤热疗 + 实时温控”的治疗范式已展现出明确的科学逻辑与可产业化价值,为国内视网膜治疗方向的创新创业团队提供了有参考意义的技术路线和转化思路。